本研究是一项多中心、前瞻性、非干预性的观察性研究。研究计划纳入胃肠道恶性肿瘤择期手术的老年(≥ 60岁)患者,记录真实临床实践中患者生活质量、术后认知功能、治疗方案、治疗结局包括死亡和术后并发症及可能相关的风险因素,采用适当的统计学方法分析识别与研究终点相关的风险因素。本研究将通过电子数据采集系统(electronic data capture system,EDC)收集各中心的患者数据。
根据围手术期定义,计划记录胃肠道恶性肿瘤择期手术患者在术前-1天(基线评估)、术中、术后1天和术后7天(如患者在术后7天前出院,则采用出院时记录)以及术后第30天的数据。
基线期,研究者徐核查入/排标准,取得患者的知情同意,并尽量收集患者的人口学资料、既往史、发病及入院情况、生命体征、术前治疗情况、合并情况及合并用药;同时收集下述临床检查资料:实验室检查(血常规、血糖、血脂、肝肾功能、凝血功能等)及相关影像学检查结果。在术中,记录患者手术方式、麻醉术前评估、麻醉用药、呼吸和血流动力学管理数据、麻醉深度、麻醉复苏、麻醉和手术小结;术后7天或者出院时,记录患者住院期间的治疗方案、收集术后并发症、再住院和入住ICU情况、术后生活质量评估、认知功能评估、胃肠道症状(GSRS)评估和患者生存状态;术后30天,记录患者30天并发症、在入院情况、生活质量评估、认知功能评估、胃肠道症状(GSRS)评估和患者生存状态。 如患者在术后7天前已经出院,则此时按出院记录处理。
研究目的
1主要目的
2次要目的
研究流程
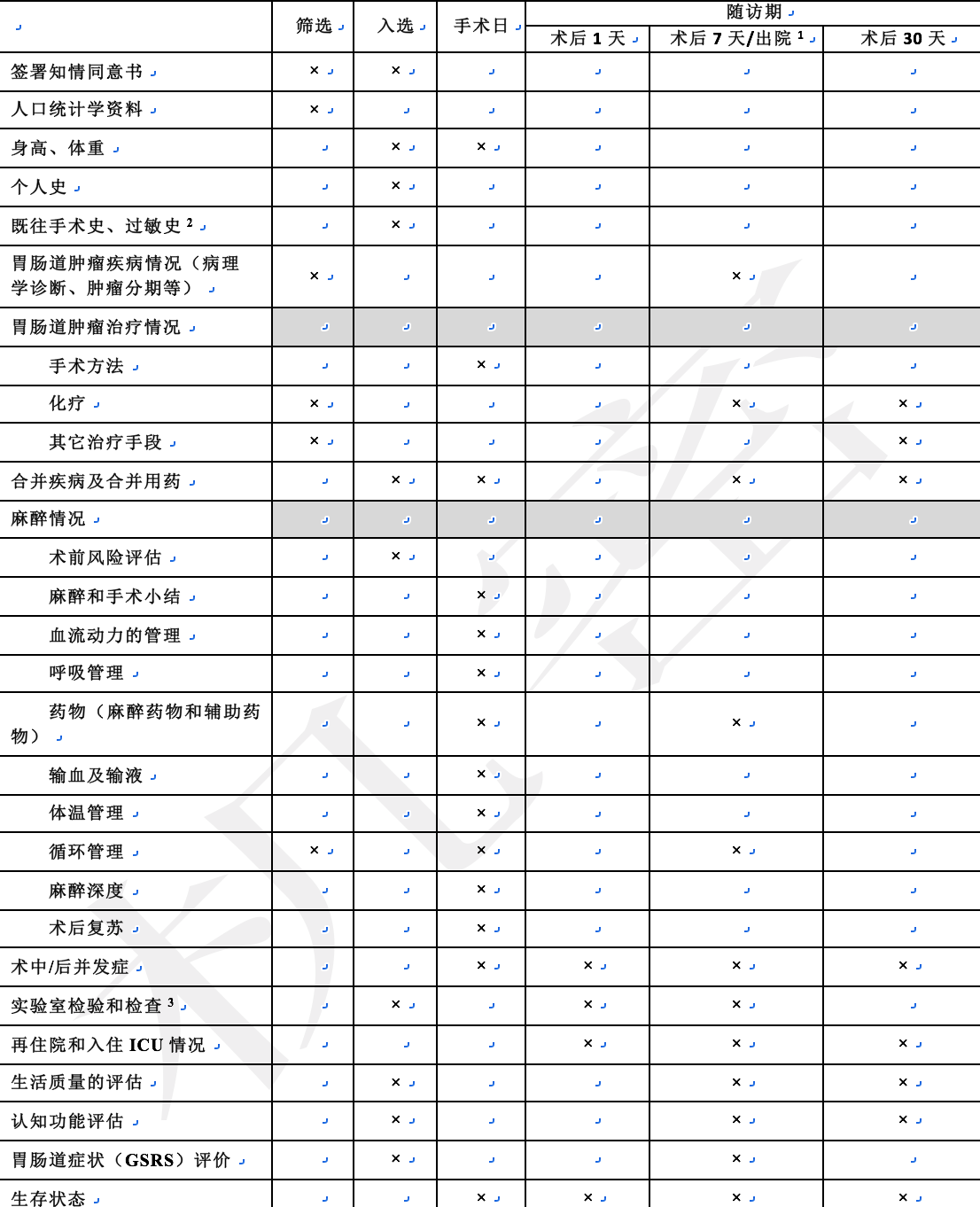
治疗方案
本研究非干预性研究,符合入选、排除标准的胃肠道肿瘤择期手术的老年(≥ 60岁)患者,本研究对于患者的治疗方案不做限定。但需遵从各家医院的诊疗规范和指南。
评价指标
1. fa评价指标
随访和评价日期
生活质量(EQ-5D量表)和认知功能(MMSE量表和CAM量表)
胃肠功能评价(GSRS量表)
2. 研究终点指标的定义
死亡事件:定义为术后30天内无论何种原因导致死亡的事件。
再住院:定义为入组本研究前至手术后30天内的非计划的住院观察和治疗
生活质量评价:采用EQ-5D量表评价生活质量,量表见附件14.1(EQ-5D量表)
认知功能评价:采用简易智能量表(MMSE量表)评价认知功能,量表见附件
因研究需要而采集、处理和保存的所有涉及个人信息的数据将始终处于保密状态,并且遵守《临床试验规范(GCP)》所规定的原则。各参研医院必须保留一个包含以下内容的卷宗:研究协议、当地研究团队的研究记录、研究所需的相关审批文件以及患者清单。如果研究产生纸质CRF,则应被存放在一个可以上锁的柜子内,并仅由熟悉个人信息处理程序以及GCP员工管理。研究者需要使用其事先网上注册时获得的用户名和密码才能进入网络数据库。参研医院与研究协调中心的电子数据的传递均采用SSL3.0协议(HTTPS)加密。
研究使用的台式电脑和笔记本电脑将使用用户名与密码,以确保数据安全。所有研究者都将按照《Research Governance Framework for Health and Social Care》相关要求事先接受培训。研究的主文件将被保留在一个符合要求的储藏室里。建议研究者在研究完成或停止后,保存研究文件至少20年,除非研究者协议中另有说明且与其他标准和/或地方法律相符。
受试者的原始文件(事先定义需要记录的关键疗效/安全性的数据)包括患者住院/门诊的记录,医生和护士的遗嘱、预约访视日期、原始的实验室检查结果、心电图、脑电图、X线射片、病理报告和特殊的评估报告、签署的知情同意书、会诊记录和受试者鉴认代码表和筛选、入选表等。
此外,研究者必须遵守关于患者记录保存的特殊地方法规/建议。
但是,如果需要延长保存期,应考虑相应的法规要求。
提供给研究者的所有材料、信息(口头或书面)和未发表的文件(或申办方为了自身利益而采取的任何措施),包括这份方案和CRF,均为申办方的专有财产。
未经申办方事先正式书面同意,研究者或其研究小组中的任何人员不得将这些材料或信息(全部和部分)提供或泄露给未经授权的人员。
除了法律要求透露的信息以外,研究者应该对研究期间收到的、获得的或推导出的所有信息保密,并采取所有必要措施保证不泄密。
申办方数据库中包括的患者的私人数据和研究者的私人数据应该按照所有适用的地方法律法规进行处理。
对研究者和/或患者的私人数据进行存档或处理时,申办方应该采取所有适当的措施来保护和防止任何未经授权的第三方访问这些数据。
研究者同意让申办方稽查员/主管当局检查员直接查阅他/她的研究记录,进行审评,当然,这些人员有义务遵守职业保密要求,因此,不能泄露任何个人身份和个人医疗信息。
研究者将尽力帮助进行稽查和检查,提供所有必需的设备、数据和文件。
一旦研究者得到主管当局即将进行检查的通知,其将通知申办方,并授权申办方参加该检查。
在这些检查期间,应该尊重已核实数据的机密性,并尊重对患者的保护制度。
对于主管当局在检查中获得的任何结果和信息,研究者必须立即告知申办方。
研究者应该采取申办方要求的适当措施,对稽查或检查中发现的所有问题进行纠正。
申办方可以随时因任何原因决定提前终止或中断研究;该决定将以书面形式通知研究者。
同样,如果研究者决定退出研究,她/他必须立即以书面形式通知申办方。
如果适用,应该按照地方法规,通知伦理委员会(IRB/IEC)和主管当局。
未经实施研究的申办方授权,不得使用任何数据。
本研究的发起方即中南大学湘雅三医院将成为所有数据的监护人。根据数据保存和分享的相关原则,项目管理委员会将在总体研究数据发表后对各种二次分析需求进行审核。审核时,管理委员会首先考虑的是提交申请的二次分析的研究质量与科学意义。只有总体的、总结性的数据可被发表,任何有关国家、医疗机构和患者个人的数据都应被严格地隐匿。具体患者数据的所有权归于各参研医院。一旦参研医院的研究协调人确定当地研究数据己完整且准确地输入电子CRF系统,其研究团队将获得一份该医院的原始数据。在EPO研究的主要研究报告发表的五年后,不涉及任何国家、机构、个人隐私的完整的EPO数据库将对公众开放,但须向管理委员会提交申请使用说明。在此之前,若研究组委会认为使用数据库的需求不符合EPO项目的宗旨,则其无义务向任何参研方或第三方开放数据。
项目管理委员会将指定一个编写委员会来起草本研究的科学报告,并及时发布。此外, EPO的研究人员可以进行类似的二次分析,并具有使用数据的优先权。这些研究的参与机会及作者排名将由研究者和参研单位对EPO研究的贡献决定。项目管理委员会在批准这些研究要求之前,将就其科学意义以及会否影响参研医院的匿名性进行商议。有时需事先签订一些必要的合作条款。所有使用EPO数据的论文在投稿之前都必须征得项目管理委员会的同意。如果项目管理委员会内部未能达成一致,则项目总协调具有裁判权。任何涉及两家或以上参研医院EPO数据的分析研究,均将被视作对EPO数据的二次分析,均适用上述规则。各参研医院一旦确认所有数据准确完整地上传后,电子CRF系统即提供该中心的所有原始数据。
项目管理委员会负责发布和/或发表。发表前,研究结果必须提交给项目管理委员会审阅。
所有研究者和委员会成员全权授权科学委员会进行结果的初次发布和/或初次发表。初次发表前,不允许有其他文献发表。此后,由研究参与者(包括子研究)进行的任何发布或发表必须经项目管理委员会批准,并以本研究和初次发表文献为参考文献。
在研究结果初次发表后,参与到本研究的研究者,研究者可以针对EPO数据中某一细分领域数据发表文献。若多位研究者同时申请,则项目管理委员会将根据该研究者在研究中的贡献度,确定最后可以使用这些数据发表文章的研究者,不排除某些领域授权多位研究者合作发表文章。
在事先通知申办方并允许其进行内部审阅和评论后,由项目管理委员会做出发表任何文献/摘要/展板的最终决定。
所有文献/摘要/报告必须在递交前提前至少45个日历日递交给申办方进行内部审阅。申办方可以将发表或通告暂时推迟一段时间,以保护其中所包含的任何信息的保密性或专有性。
必要时,可以组建一个发表委员会,负责总体发表计划。它的主要工作包括:
申办方指派的临床监查员定期对研究医院进行现场监查访问,以确保研究方案的所有内容都得到严格遵守及保证研究资料填写的正确性和完整性。除监查拜访外,定期沟通(通过邮件、电话、传真等)以确保所有的研究活动符合方案要求和法规要求。
临床试验中所有观察结果和发现都应加以核实,以保证数据的可靠性,确保临床试验中各项结论来源于原始数据。在临床试验和数据处理阶段均有相应的数据管理措施。